Валентность химических элементов
Нас арифметикой банальною не мучай,
Над нами лишь Клечковский — господин,
А он сказал, что 3+2 получше
Чем, например, 4+1
Мнемоническое правило на правило Клечковского
Понятие о валентности
Молекулы состоят из атомов. А атомы в молекуле связаны химическими связями. Когда атом в молекуле связан только с одним другим атомом, то такой атом будет считаться одновалентным. Если атом соединен с двумя другими атомами в молекуле, то такой атом будет считаться двухвалентным. Соответственно, когда атом соединен с тремя другими атомами, то мы считаем его трехвалентным и так далее.
Валентностью элемента называют число химических связей, которые образует атом в молекуле или число электронных пар, которыми данный атом связан с другими атомами. атомами.
Валентность не имеет знака!
Валентность обозначается римскими цифрами: I, II, III, IV, V, VI, VII, VIII и записывают над химическими символами.
Основываясь на данных о составе вещества можно вывести химическую формулу. Чаще всего при составлении формул опираются на закономерности, которым подчиняются химические элементы, соединяясь между собой.
Посмотрите на эти примеры химических формул:
Из примеров видно, что атомы элементов хлора (Cl), кислорода (O), азота (N), углерода (C) присоединяют не любое, а определенное число атомов водорода (H) — 1, 2, 3 и 4 атома соответственно.
Между атомами в химических соединениях существуют химические связи. Посмотрите на те же самые формулы, но написанные по-другому.
Графические формулы
| H — Cl | H — O — H |
 | 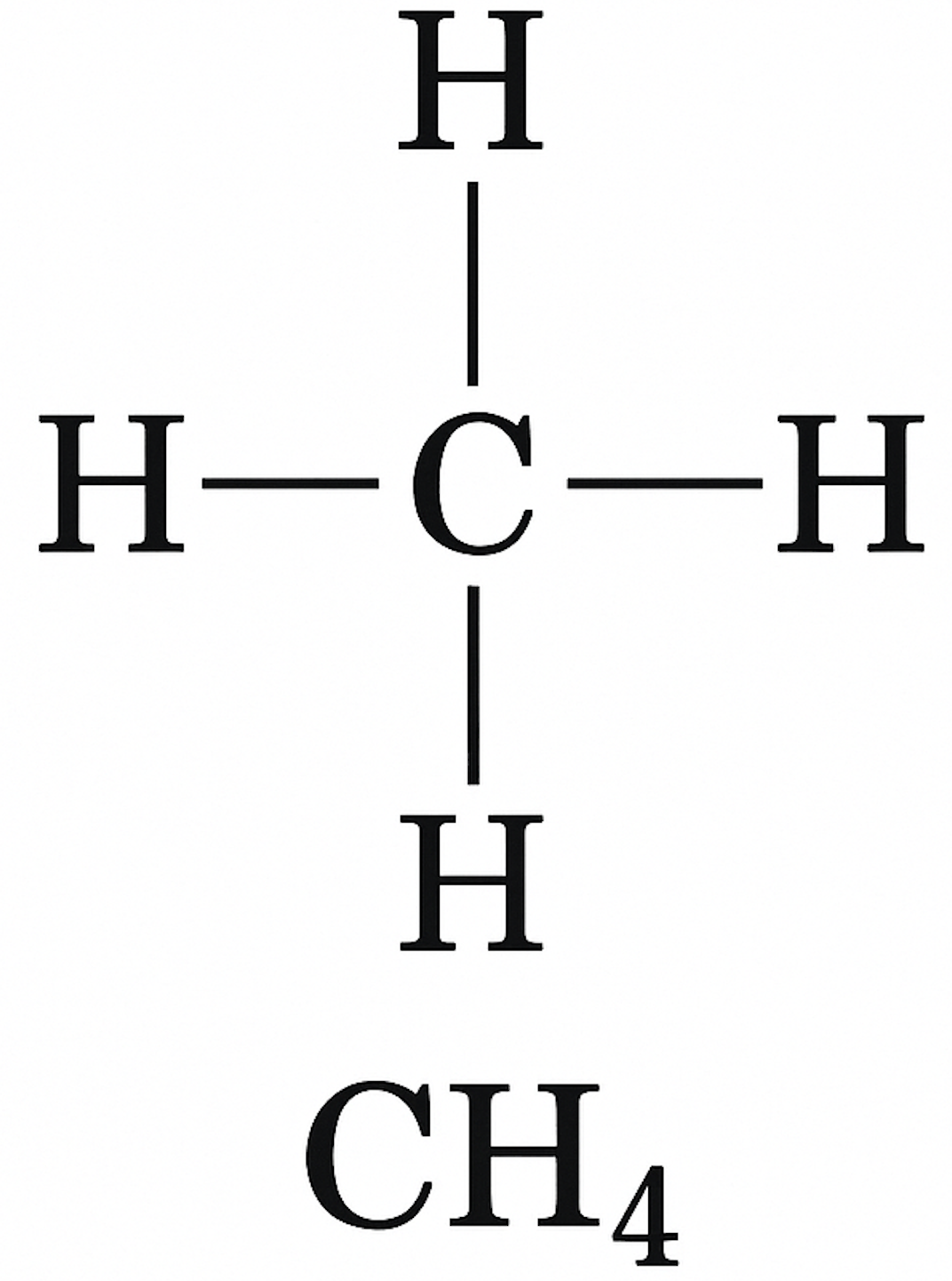 |
Такие формулы называются графическими.
Графические формулы веществ — это формулы, показывающие порядок соединения атомов в молекулах и число связей, которые образует каждый атом.
В приведенных выше примерах графических формул молекул атом водорода образует одну связь, поэтому валентность водорода в этих формулах равна I (единице). В молекуле HCl атом хлора образует одну связь, его валентность равна I, атом кислорода (O) в молекуле H2O образует две связи и его валентность равна II, валентность азота (N) в молекуле NH3 равна III, а валентность углерода (C) в молекуле CH4 — IV.
Постоянная валентность
У некоторых химических элементов постоянная валентность. Свойственна атомам элементов, стоящих в 1-3 группах главных подгруппах ПСХЭ Д.И. Менделеева, а также водороду (H), кислороду (O) и фтору (F).
Элементы с постоянной валентностью — это элементы, которые во всех соединениях проявляют одинаковую валентность.
Постоянная валентность, как правило, соответствует номеру группы, в которой находится данный элемент.
Постоянной валентностью I обладают элементы:
- водород H;
- фтор F;
- щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb и цезий Cs;
У этих одновалентных элементов атомы всегда образуют только одну связь.
Постоянной валентностью II обладают элементы:
- кислород O;
- магний Mg;
- бериллий Be;
- кальций Ca;
- стронций Sr;
- барий Ba;
- цинк Zn.
Постоянной валентностью III обладают элементы:
- бор B;
- алюминий Al.
Переменная валентность
У большинства элементов валентность переменная. Свойственна атомам элементов, стоящих в 4-8 группах и 1-3 группах побочных подгруппах ПСХЭ Д.И. Менделеева.
Элементы с переменной валентностью — это элементы, имеющие в разных соединениях различную валентность.
Переменная валентность может быть:
- высшая — соответствует номеру группы (например, азот (N) находится в V группе и его высшая валентность будет равна пяти V, хлор (Cl) находится в VII группе и его высшая валентность равна семи VII);
- низшая — равна значению «8 – номер группы», но есть исключения;
- промежуточная — в 6 и 7 группах равна ±2 от низшего или высшего значения элемента. То есть плюс к низшему значению или минус от высшего значения валентности элемента.
Например, сера (S) имеет высшую валентность VI (как номер группы), низшую валентность II (8-6=2) и промежуточную валентность IV (6-2=4 или 2+2=4).
Число химических связей у элементов с переменной валентностью может меняться в зависимости от того в каком соединении эти элементы присутствуют.
| Элементы | Наиболее характерные валентности |
| Cl (хлор), Br (бром), I (йод) | I, III, V, VII |
| S (сера) | II, IV, VI |
| C (углерод), Si (кремний), Sn (олово), Pb (свинец) | II, IV |
| P (фосфор) | III, V |
| Ag (серебро), Au (золото) | I, III |
| Cu (медь) | I, II |
| Fe (железо) | II, III |
| Cr (хром) | II, III, VI |
| Mn (марганец) | II, III, IV, VI, VII |
Теория (метод) валентных связей
Электронная формула (конфигурация) представляет расположение электронов на электронных оболочках (уровнях и подуровнях) в атоме химического элемента.
Электронно-графическая формула атома химических элементов — это расположение электронов на орбиталях атома.
В такой формуле все электроны помечаются стрелочками (↑↓), а квадратиками — орбитали.
Валентный уровень — внешний электронный слой атома.
Важно!
Валентность химического элемента, согласно теории валентных связей, определяется количеством свободных (не спаренных) электронов на внешнем (валентном) уровне.
| Атом | Электронная формула зеленым фоном выделен валентный уровень | Электронно-графическая формула |
Кислород: O+8 Кислород имеет заряд +8 и находится во втором периоде. Кислород во всех соединениях проявляет валентность — II (два). | 1s22s22p4 | 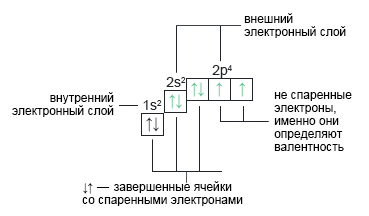 |
Сера: S+16 Сера имеет заряд +16 и находится в третьем периоде. Сера может иметь валентности: II, IV и VI. | 1s22s22p63s23p43d0 | 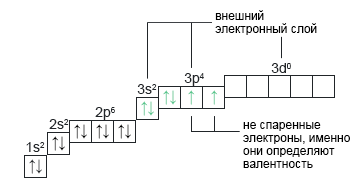 |
Сера: *S+16 При наличии вакантных орбиталей (в случае с серой — d-орбиталь) электронные пары могут распариваться. Обратите внимание на перешедший на d-подуровень электрон с p-подуровня. Такой переход электрона возможен только когда атом получает избыток энергии, то есть переходит в возбужденное состояние. | 1s22s22p63s23p33d1 | 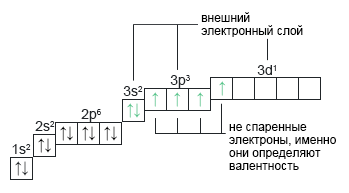 |
Сера: **S+16 Распаривание электронов возможно только на валентном уровне. Замечаем, что у нас остается не распаренная электронная пара на 3s2. Именно отсюда еще один электрон переходит на d-подуровень при получении атомом еще большего избытка энергии. Не спаренных электронов становится шесть, поэтому валентность серы в таком состоянии тоже равно VI. Больше распаривать нечего, поэтому VI — максимальное валентное состояние атома серы. | 1s22s22p63s13p33d2 | 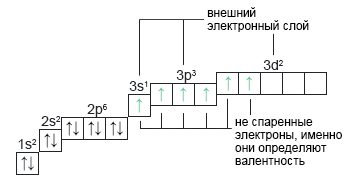 |
Хлор: Cl+17 Хлор имеет заряд +17 и находится в третьем периоде седьмой группы главной подгруппы. Хлор может иметь валентности: I, III, V и VII. В третьем периоде возникает d-подуровень. И в спокойном состоянии (не в возбужденном) атом хлора имеет валентность I. Подуровень d есть, но он свободен.
| 1s22s22p63s23p53d0 | 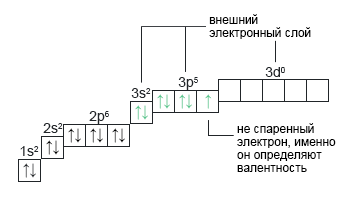 |
Хлор: *Cl+17 В возбужденном состоянии происходит распаривание ближайшей пары к первому не спаренному электрону. Электрон переходит на d-подуровень. Появляется три неспаренных электрона и валентность равна III. | 1s22s22p63s23p43d1 | 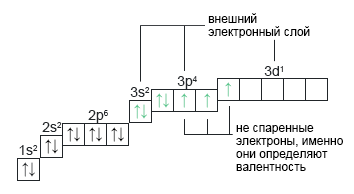 |
Хлор: **Cl+17 В более возбужденном состоянии происходит распаривание следующей ближайшей пары к первому не спаренному электрону. Электрон переходит на d-подуровень. Появляется пять неспаренных электронов и валентность равна V. | 1s22s22p63s23p33d2 | 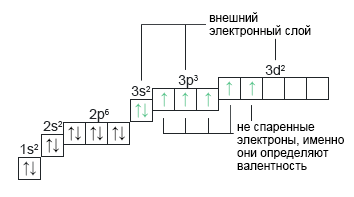 |
Хлор: ***Cl+17 В еще более возбужденном состоянии происходит распаривание следующей ближайшей пары к первому не спаренному электрону. Электрон переходит на d-подуровень. Появляется семь неспаренных электронов и валентность равна VII. | 1s22s22p63s13p33d3 | 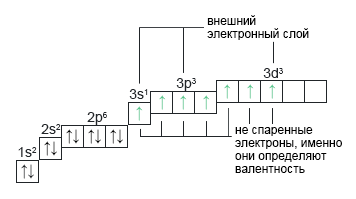 |
Азот: N+7 Азот находится во втором периоде. У него нет d-подуровня (электронам некуда «перепрыгивать», как у серы или хлора), поэтому валентность III — это максимальная валентность для азота. | 1s22s22p3 | 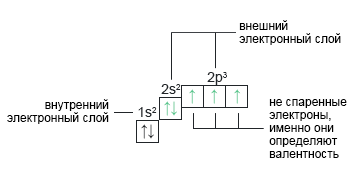 |
Особенность строения соединения HNO3 — азотная кислотаВалентность азота равна трем. Казалось бы, следуя этой логике валентность азота в соединении HNO3 должна была быть тоже равна трем. Но нет. | ||
Внимание!
Помните, что химия — наука исключений.
У атомов побочных подгрупп Периодической системы встречается «проскок» электрона. Например, у хрома (Cr) с порядковым номером 24 один из электронов с 4s-уровня переходит в ячейку d-уровня. Похожий эффект есть у молибдена (Mo), ниобия (Nb) и др.Кроме того, есть понятие возбужденного состояния атома, когда спаренные электроны распариваются и переходят на соседние орбитали. Поэтому при составлении электронно-графических формул элементов пятого и последующих периодов побочной подгруппы сверяйтесь со справочником!